مرجع پلیمر در بازار ایران (پلیم پارت):
چکیده
اگرچه رویکرد کیفیت بر اساس طراحی (QbD) بطور گسترده برای توسعه محصولات دارویی و تضمین و بهبود کیفیت محصول استفاده میگردد، مطالعات روی این رویکرد برای سیستمهای پچ ترانس درمال (TPSs) محدود است. با توجه به مزایای مختلف مانند کاهش تهاجمی، اجتناب از متابولیسم عبور اول و بهبود راحتی و انطباق، TPS وضعیت دوزی جذاب برای توسعه محصول دارویی است.
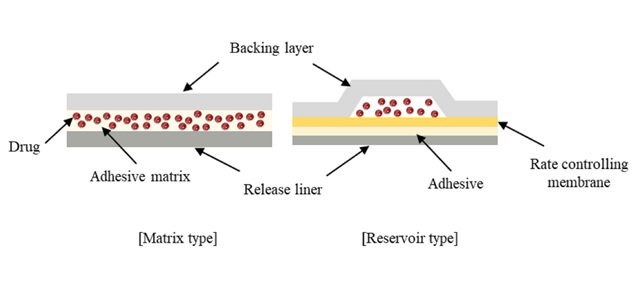
این مطالعه مشخصات محصول هدف با کیفیت (QTPP)، ویژگیهای کیفیت حیاتی (CQA) و ویژگیهای مواد حیاتی (CMAs) TPS را برای QbD بررسی نمود. توجیه این رویکرد با مقایسه استانداردهای واحدهای نظارتی و برخی از پیادهسازیهای CQAs و CMA با دادههای مربوط به پژوهشها و داروسازیهای مختلف مورد قضاوت قرار گرفتهاست. عناصر QTPP به طور کلی به شرح زیر میباشد: وضعیت دوز و قدرت، ماندگاری، فارماکوکینتیک و ویژگیهای کیفیت محصول دارویی. CMAها به شرح زیر میباشد: دارو (ضریب تقسیم، اندازه و شکل ذرات، چند شکلی، نقطه ذوب، حلالیت، pH و یونیزاسیون)، چسب حساس به فشار (PSA) (گرانروی، نوع چسب، جریان سرد و وزن مولکولی) و سایر مواد جانبی (افزایش دهندههای نفوذ، بازدارندههای تبلور، غشاهای کنترلکننده سرعت و حلالها). CQAها به شرح زیر میباشد: آزمایشهای فیزیکوشیمیایی (آزمایش، میزان رطوبت، استقامت تا خوردگی، استحکام کششی و نفوذ بخار آب)، آزمایشهای خواص چسب (مقاومت پوستگی، چسبندگی و چسبندگی برشی)، آزمونهای آزمایشگاهی (رهایش دارو، نفوذ دارو)، ناخالصیها و فرآوردههای تخریب دارو و آزمون تحریک پوستی.
این مطالعه نشان میدهد که رویکرد QbD برای توسعه TPS میتواند ریسک را کاهش دهد، کیفیت محصول را بهبود بخشد و نتایج با کیفیت را به طور مداوم ایجاد نماید.
نتیجهگیری
بر اساس راهنمایی از منابع مختلف مانند سازمان غذا و داروی ایالات متحده، USP، BP، JP و فارماکوپه کرهای، و همچنین منابع مربوطهی این بررسی QTPP، CQA و CMAs را برای توسعه محصول TPS ارائه مینماید. با استفاده از رویکرد QbD علاوهبر این، مقایسه استاندارهای سازمانهای نظارتی و برخی از پیادهسازیهای CQA و CMA ارائه شده است. حتی اگر TPS وضعیت دوز گستردهای برای داروهای مختلف باشد، سازمانهای نظارتی ممکن است روش ارزیابی بهینه برای کیفیت محصول دارویی قوی و ثابت را ارائه ننمایند. بنابراین شرکتیها داروسازی، محصولات TPS را با استانداردها و روشهای خاص خود ارزیابی نمودهاند. سازمانهای نظارتی باید روشها و استانداردهای ارزیابی مناسبی را که ترکیبی از ارزیابیهای کمی و کیفی است، گنجانده و بهبود ببخشند، مشکلات ایمنی و اثربخشی مداوم را به حداقل میرسانند و از تحویل قوی و کافی دارو اطمینان میدهند.
دانلود فایل: رویکرد کیفیت براساس طراحی برای توسعه سیستمهای پچ ترانسدرمال و دیدگاه نظارتی
Reference
Kim EJ, Choi DH. Quality by design approach to the development of transdermal patch systems and regulatory perspective. Journal of Pharmaceutical Investigation. 2021 Nov;51(6):669-90.
DOI: http://dx.doi.org/10.1007/s40005-021-00536-w
مترجم: مبینا بسکابادی